Combien de recombinaisons sont nécessaires pour obtenir un virus actif?
La FDA a reconnu la probabilité que les lentivecteurs puissent être convertis en lentivirus à réplication active s’ils subissent une recombinaison avec le type sauvage VIH chez un patient séropositif. Dans ce cas, deux événements de recombinaison sont nécessaires pour transférer la séquence lentivecteur dans la séquence VIH (le mécanisme de transfert est identique au cas des lentivecteurs de première génération).
Cet article de VCU décrit un autre mécanisme par lequel cela peut se produire dans les systèmes lentivecteurs de première génération , qui consiste en deux événements de recombinaison entre le lentivecteur et le plasmide auxiliaire. Notez que les 3 gènes gag, pol et env sont présents sur le même plasmide, et que ce plasmide est flanqué de LTR. Les lentivecteurs de deuxième génération, tels que le système pLKO, ne souffrent pas de ce problème et ont besoin du VIH de type sauvage pour produire des lentivirus à réplication active.
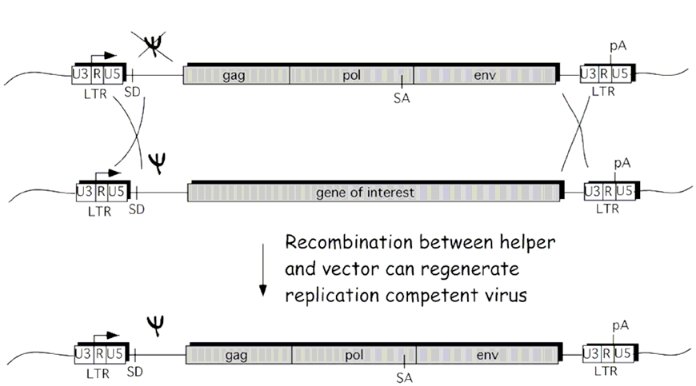
Pour réduire la probabilité que cela se produise, les systèmes lentivecteurs de deuxième et troisième générations divisent les gènes en plusieurs plasmides, ce qui nécessite alors plus d'événements de recombinaison pour produire des virus capables de se répliquer. De plus, la queue polyA de la LTR 3 'est remplacée pour réduire la probabilité que des événements de recombinaison se produisent.
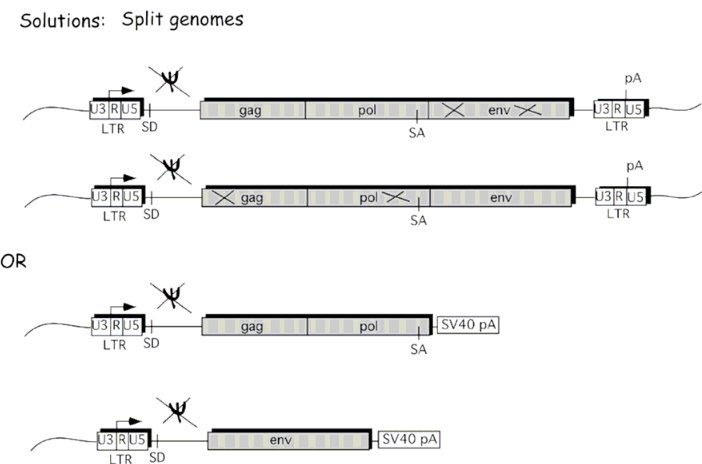
Selon l ' article d'Addgene sur la biosécurité des lentivecteurs, le plasmide de transfert du gène d'intérêt (à la fois des 2e et 3e générations) a une délétion dans la région 3' LTR qui l'empêche de devenir réplicative active. Par conséquent, la seule probabilité que la recombinaison se produise est que la lignée cellulaire exprimant le virus subisse une réplication avec une souche active de VIH de type sauvage. Un exemple est ce plasmide de transfert pLKO, qui contient une LTR 3 'tronquée, empêchant la séquence de se répliquer en dehors de E. coli , qui le réplique sans utiliser le LTR mais à la place en utilisant l'origine plasmidique de réplication.
Les virus actifs produits par recombinaison sont-ils plus dangereux à l'état sauvage que le VIH de type sauvage?
Il est difficile de répondre, car la recombinaison ne permet qu'un virus actif de se former, mais c'est le cas ne garantit pas que le virus sera dangereux. Des virus dangereux sont théoriquement possibles, mais nécessitent beaucoup plus de recombinaisons que le minimum 2 pour la compétence de réplication dans les systèmes lentivecteurs de 2ème génération.
Par exemple, les systèmes lentivecteurs ne codent généralement pas pour les protéines virales vpr, vif , nef et vpu . Ces protéines sont nécessaires pour augmenter l'infectivité du VIH dans différents types de tissus (mais pas dans les cellules cultivées telles que HEK293). Le manque de ces protéines dans un lentivecteur hypothétique compétent pour la réplication entraverait considérablement sa propagation dans la nature. L'incorporation de ces protéines est plausible mais extrêmement improbable, car davantage d'événements de recombinaison croisée seront nécessaires.
Pour utiliser votre exemple, la protéine env codant pour l'enveloppe de la protéine VSV réside dans le plasmide d'enveloppe. Étant donné que le lentivecteur compétent pour la réplication formé par 2 événements de recombinaison sera un pseudotype contenant uniquement les protéines du VIH env , il devra en outre acquérir le gène VSV pour remplacer son env , car ces gènes ne sont pas présents sur les mêmes régions. Il n'y a pas d'homologie entre les deux brins d'ADN, ce qui entraverait considérablement la probabilité que le gène VSV soit en quelque sorte incorporé dans le VIH actif.
L'ajout de diverses protéines chimériques et régions LTR dans les lentivecteurs de 3ème génération ne fait que compliquer les choses.
Dans l'ensemble, je n'ai pas pu trouver de sources comparant l'infectivité de ces VIH transgéniques théoriques par rapport au type sauvage. Cependant, même s'il est théoriquement possible qu'un lentivecteur compétent pour la réplication transgénique puisse avoir un meilleur tropisme que le VIH en acquérant le gène VSV, la probabilité que cela se produise est bien inférieure à celle de sa production en premier lieu.
Un lentivecteur peut-il être détecté par un test VIH?
En ce qui concerne la question finale de savoir si un lentivecteur peut être détecté par un test VIH standard, la réponse est que la détection est possible si la personne qui a été infectée par des lentivecteurs a obtenu une réponse immunitaire aux protéines gag lentivectorales, et les charges de lentivecteurs sont suffisamment élevées.
Les tests de dépistage du VIH sont spécifiques à différentes parties du virus, mais la plupart d’entre eux ciblent la protéine virale p24, qui est une composante du gag polyprotéine.
Des tests VIH basés sur la PCR existent également, mais ces tests dépendraient des amorces spécifiques produites et si la RT-PCR produirait un amplicon étant donné la séquence spécifique des plasmides.
Étant donné que les gènes gag sont codés pour dans la plupart des systèmes lentivecteurs, il est donc très probable que toute personne infectée par un lentivecteur exprime donc des anticorps dirigés contre p24, et donc entraîne également un résultat positif pour l'ELISA comme les tests Western blot en supposant que les quantités de p24 et d'anticorps sont suffisamment élevées pour atteindre le point de coupure.
Je n'ai pas été en mesure de trouver des seuils publiquement disponibles pour les niveaux ELISA et Western blot, mais si (hypothétiquement parlant) une personne recevait une injection de lentivecteurs, elle serait probablement testée positive pour le VIH. Cependant, comme le lentivecteur ne se reproduit pas activement, il serait rapidement éliminé par le système immunitaire.